Ang mga antibodies, na tinatawag ding immunoglobulins (Ig), ay mga glycoprotein na partikular na nagbubuklod sa mga antigen.
Ang tradisyonal na paghahanda ng antibody ay ginawa sa pamamagitan ng pagbabakuna sa mga hayop at pagkolekta ng antiserum.Samakatuwid, ang antiserum ay karaniwang naglalaman ng mga antibodies laban sa iba pang mga hindi nauugnay na antigens at iba pang bahagi ng protina sa serum.Ang mga pangkalahatang molekula ng antigen ay kadalasang naglalaman ng maraming iba't ibang mga epitope, kaya ang mga kumbensyonal na antibodies ay pinaghalong mga antibodies laban sa maraming iba't ibang mga epitope.Kahit na ang conventional serum antibodies na nakadirekta laban sa parehong epitope ay binubuo pa rin ng mga heterogenous antibodies na ginawa ng iba't ibang B cell clone.Samakatuwid, ang conventional serum antibodies ay tinatawag ding polyclonal antibodies, o polyclonal antibodies para sa maikli.
Ang monoclonal antibody (monoclonal antibody) ay isang lubos na pare-parehong antibody na ginawa ng isang solong B cell clone at nakadirekta lamang laban sa isang partikular na epitope.Karaniwan itong inihahanda ng teknolohiyang hybridoma—ang teknolohiya ng hybridoma antibody ay nakabatay sa teknolohiya ng cell fusion, na pinagsasama-sama ang mga B cell na may kakayahang mag-secrete ng mga partikular na antibodies at myeloma cell na may walang katapusang kapasidad ng paglago sa B-cell hybridomas .Ang hybridoma cell na ito ay may mga katangian ng isang parent cell.Maaari itong dumami nang walang hanggan at walang kamatayan sa vitro tulad ng mga myeloma cells, at maaari itong mag-synthesize at mag-secrete ng mga partikular na antibodies tulad ng splenic lymphocytes.Sa pamamagitan ng pag-clone, ang isang monoclonal na linya na nagmula sa isang hybridoma cell, iyon ay, isang hybridoma cell line, ay maaaring makuha.Ang mga antibodies na ginagawa nito ay lubos na homogenous na antibodies laban sa parehong antigenic determinant, iyon ay, monoclonal antibodies.
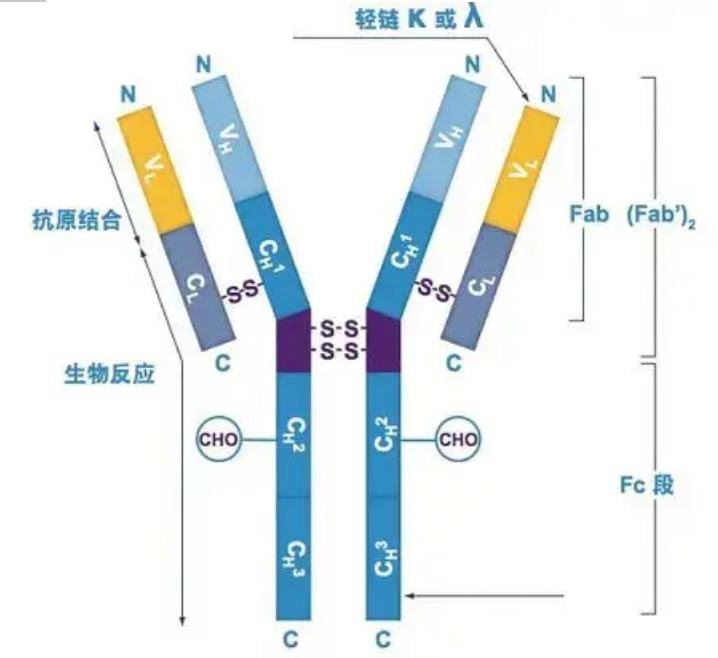
Umiiral ang mga antibodies bilang isa o higit pang mga monomer na hugis Y (ibig sabihin, monoclonal antibodies o polyclonal antibodies).Ang bawat monomer na hugis Y ay binubuo ng 4 na polypeptide chain, kabilang ang dalawang magkaparehong mabibigat na chain at dalawang magkaparehong light chain.Ang light chain at heavy chain ay pinangalanan ayon sa kanilang molekular na timbang.Ang tuktok ng hugis-Y na istraktura ay ang variable na rehiyon, na kung saan ay ang antigen binding site.(Sipi mula sa Detai Bio-Monoclonal Antibody Concept)
Istraktura ng antibody
 Mabigat na kadena
Mabigat na kadena
Mayroong limang uri ng mabibigat na kadena ng mammalian Ig, pinangalanan sa mga letrang Griyego na α, δ, ε, γ, at μ.Ang kaukulang antibodies ay tinatawag na IgA, IgD, IgE, IgG, at IgM.Ang iba't ibang mabibigat na kadena ay naiiba sa laki at komposisyon.Ang α at γ ay naglalaman ng humigit-kumulang 450 amino acid, habang ang μ at ε ay naglalaman ng humigit-kumulang 550 amino acid.
Ang bawat mabibigat na kadena ay may dalawang rehiyon: ang pare-parehong rehiyon at ang variable na rehiyon.Ang lahat ng antibodies ng parehong uri ay may parehong pare-parehong rehiyon, ngunit may mga pagkakaiba sa pagitan ng mga antibodies ng iba't ibang uri.Ang mga pare-parehong rehiyon ng mabibigat na kadena γ, α, at δ ay binubuo ng tatlong Ig domain na magkakasunod, na may rehiyon ng bisagra upang mapataas ang flexibility nito;ang mga pare-parehong rehiyon ng mabibigat na kadena μ at ε ay binubuo ng 4 na domain ng Ig.Ang variable na rehiyon ng mabibigat na kadena ng antibody na ginawa ng iba't ibang B cell ay iba, ngunit ang variable na rehiyon ng antibody na ginawa ng parehong B cell o cell clone ay pareho, at ang variable na rehiyon ng bawat mabibigat na chain ay humigit-kumulang 110 amino acid ang haba., At bumuo ng isang solong Ig domain.
Banayad na kadena
Mayroon lamang dalawang uri ng light chain sa mga mammal: uri ng lambda at uri ng kappa.Ang bawat light chain ay may dalawang naka-link na domain: isang pare-parehong rehiyon at isang variable na rehiyon.Ang haba ng light chain ay mga 211~217 amino acids.Ang dalawang light chain na nakapaloob sa bawat antibody ay palaging pareho.Para sa mga mammal, ang light chain sa bawat antibody ay may isang uri lamang: kappa o lambda.Sa ilang mas mababang vertebrates, tulad ng mga cartilaginous na isda (cartilage fish) at bony fish, matatagpuan din ang iba pang mga uri ng light chain tulad ng iota (iota).
Mga segment ng Fab at Fc
Ang Fc segment ay maaaring direktang pagsamahin sa mga enzyme o fluorescent dyes upang lagyan ng label ang mga antibodies.Ito ay ang bahagi kung saan ang antibody rivets sa plato sa panahon ng proseso ng ELISA, at ito rin ang bahagi kung saan ang pangalawang antibody ay kinikilala at nakatali sa immunoprecipitation, immunoblotting at immunohistochemistry.Ang mga antibodies ay maaaring i-hydrolyzed sa dalawang F(ab) segment at isang Fc segment sa pamamagitan ng proteolytic enzymes gaya ng papain, o maaari silang masira mula sa hinge region sa pamamagitan ng pepsin at hydrolyzed sa isang F(ab)2 segment at isang Fc segment.Ang mga fragment ng IgG antibody ay kung minsan ay lubhang kapaki-pakinabang.Dahil sa kakulangan ng Fc segment, ang F(ab) na segment ay hindi namumuo kasama ng antigen, at hindi rin ito kukunan ng immune cells sa mga pag-aaral sa vivo.Dahil sa maliliit na molecular fragment at kakulangan ng cross-linking function (dahil sa kakulangan ng Fc segment), ang Fab segment ay karaniwang ginagamit para sa radiolabeling sa functional studies, at ang Fc segment ay pangunahing ginagamit bilang blocking agent sa histochemical staining.
Variable at pare-pareho ang mga rehiyon
Ang variable na rehiyon (rehiyon ng V) ay matatagpuan sa 1/5 o 1/4 (naglalaman ng humigit-kumulang 118 amino acid residues) ng H chain malapit sa N-terminus at 1/2 (naglalaman ng humigit-kumulang 108-111 amino acid residues) malapit sa N-terminus ng L chain .Ang bawat rehiyon ng V ay may peptide ring na nabuo sa pamamagitan ng intra-chain disulfide bond, at ang bawat peptide ring ay naglalaman ng humigit-kumulang 67 hanggang 75 amino acid residues.Ang komposisyon at pag-aayos ng mga amino acid sa rehiyon ng V ay tumutukoy sa antigen binding specificity ng antibody.Dahil sa patuloy na pagbabago ng mga uri at pagkakasunud-sunod ng mga amino acid sa rehiyon ng V, maraming uri ng mga antibodies na may iba't ibang mga binding antigen specificities ang maaaring mabuo.Ang mga V na rehiyon ng L chain at H chain ay tinatawag na VL at VH, ayon sa pagkakabanggit.Sa VL at VH, ang komposisyon at pagkakasunud-sunod ng amino acid ng ilang lokal na rehiyon ay may mas mataas na antas ng pagkakaiba-iba.Ang mga rehiyong ito ay tinatawag na hypervariable regions (HVR).Ang komposisyon at pag-aayos ng amino acid ng mga hindi HVR na bahagi sa rehiyon ng V ay medyo konserbatibo, na tinatawag na rehiyon ng balangkas.Mayroong tatlong hypervariable na rehiyon sa VL, karaniwang matatagpuan sa mga residue ng amino acid na 24 hanggang 34 at 89 hanggang 97 ayon sa pagkakabanggit.Ang tatlong HVR ng VL at VH ay tinatawag na HVR1, HVR2 at HVR3, ayon sa pagkakabanggit.Ang pananaliksik at pagsusuri ng X-ray crystal diffraction ay nagpatunay na ang hypervariable na rehiyon ay talagang ang lugar kung saan ang antibody antigen ay nagbubuklod, kaya tinawag itong complementarity-determining region (CDR).Ang HVR1, HVR2 at HVR3 ng VL at VH ay maaaring tawaging CDR1, CDR2 at CDR3 ayon sa pagkakabanggit.Sa pangkalahatan, ang CDR3 ay may mas mataas na antas ng hypervariability.Ang hypervariable na rehiyon ay din ang pangunahing lokasyon kung saan umiiral ang idiotypic determinants ng Ig molecules.Sa karamihan ng mga kaso, ang H chain ay gumaganap ng isang mas mahalagang papel sa pagbubuklod sa antigen.
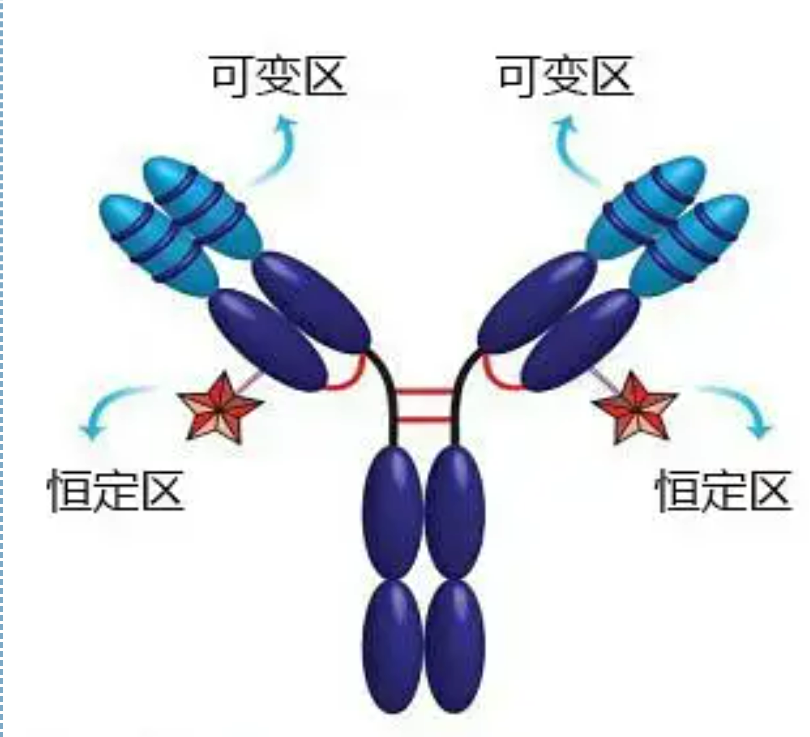 Ang pare-parehong rehiyon (C rehiyon)ay matatagpuan sa 3/4 o 4/5 (humigit-kumulang mula sa amino acid 119 hanggang sa C terminal) ng H chain malapit sa C terminal at 1/2 (naglalaman ng humigit-kumulang 105 amino acid residues) malapit sa C terminus ng L chain.Ang bawat functional na rehiyon ng H chain ay naglalaman ng humigit-kumulang 110 amino acid residues, at naglalaman ng peptide ring na binubuo ng 50-60 amino acid residues na konektado ng disulfide bond.Ang komposisyon at pag-aayos ng amino acid ng rehiyong ito ay medyo pare-pareho sa parehong Ig isotype L chain ng hayop at sa parehong uri ng chain H.Ang parehong, maaari lamang itong partikular na magbigkis sa kaukulang antigen, ngunit ang istraktura ng rehiyon ng C nito ay pareho, iyon ay, mayroon itong parehong antigenicity.Ang horse anti-human IgG secondary antibody (o anti-antibody) ay maaaring pagsamahin sa dalawang A combination of antibodies (IgG) laban sa iba't ibang exotoxin ay nangyayari.Ito ay isang mahalagang batayan para sa paghahanda ng pangalawang antibodies at paglalapat ng fluorescein, isotopes, enzymes at iba pang may label na antibodies.
Ang pare-parehong rehiyon (C rehiyon)ay matatagpuan sa 3/4 o 4/5 (humigit-kumulang mula sa amino acid 119 hanggang sa C terminal) ng H chain malapit sa C terminal at 1/2 (naglalaman ng humigit-kumulang 105 amino acid residues) malapit sa C terminus ng L chain.Ang bawat functional na rehiyon ng H chain ay naglalaman ng humigit-kumulang 110 amino acid residues, at naglalaman ng peptide ring na binubuo ng 50-60 amino acid residues na konektado ng disulfide bond.Ang komposisyon at pag-aayos ng amino acid ng rehiyong ito ay medyo pare-pareho sa parehong Ig isotype L chain ng hayop at sa parehong uri ng chain H.Ang parehong, maaari lamang itong partikular na magbigkis sa kaukulang antigen, ngunit ang istraktura ng rehiyon ng C nito ay pareho, iyon ay, mayroon itong parehong antigenicity.Ang horse anti-human IgG secondary antibody (o anti-antibody) ay maaaring pagsamahin sa dalawang A combination of antibodies (IgG) laban sa iba't ibang exotoxin ay nangyayari.Ito ay isang mahalagang batayan para sa paghahanda ng pangalawang antibodies at paglalapat ng fluorescein, isotopes, enzymes at iba pang may label na antibodies.
Kaugnay na Mga Produkto:
Cell Direct RT-qPCR kit
Oras ng post: Set-30-2021








